Антикоагулянты и антитромбоцитарные лекарства
Важна ли разница?
Врачи практически любой клинической специальности сталкиваются с различными вопросами о назначении лекарственных препаратов, которые направлены на снижение коагуляционного свойства крови. Такие вопросы возникают как в лечении сердечно-сосудистых заболеваний, так и при выполнении профилактических мер при лечении широкого ряда других состояний. Для лечения таких заболеваний/состояний (к сожалению, не всех) существуют клинические протоколы, где подробно расписаны лекарственные препараты, и куда можно заглянуть при назначении соответствующей терапии, но для полного понимания этих протоколов, необходимо знать основные моменты и особенности.
Википедия гласит, что система гемостаза — это биологическая система в организме, функция которой заключается в сохранении жидкого состояния крови, остановке кровотечений при повреждениях стенок сосудов и растворении тромбов, выполнивших свою функцию. Классически выделяют три механизма: сосудисто-тромбоцитарный гемостаз, коагуляционный гемостаз, фибринолиз. Конечным итогом цикла свёртывающей системы крови является превращение фибриногена в волокна фибрина под действием тромбина. Любой сгусток/свёрток, который образуется в сосудах, является тромбоцитарно-фибриновым. Завершающий этап работы цикла системы гемостаза — фибринолиз. Система фибринолиза разрушает фибриновый сгусток по мере того, как повреждённый сосуд восстанавливается, и необходимость в наличии сгустка пропадает.
И далее все повторяется, по спирали.
Эндотелий – однослойный пласт клеток, выстилающий изнутри всё сердечно-сосудистое древо. Является активным эндокринным органом, диффузно рассеян по всем тканям (где есть сосуды). Эндотелиоцитам присуще множество функций, среди которых: синтез субстанций для контроля свертывания крови, регуляции сосудистого тонуса, артериального давления, фильтрационной функции почек, сократительной активности сердца, метаболического обеспечения мозга. Эндотелий реагирует на механическое воздействие протекающей крови, величину давления крови в просвете сосуда и степень напряжения мышечного слоя сосуда. Клетки эндотелия чувствительны к химическим воздействиям, которые могут приводить к повышенной агрегации и адгезии циркулирующих клеток крови, развитию тромбоза, оседанию липидных конгломератов.
Мое мнение, что тот, кто найдет лекарство для “стабилизации эндотелия”, - сможет претендовать на высшую награду научного сообщества.
К сожалению, убивать друг друга узконосые обезьяны (Catarrhini) научились задолго до появления самого понятия «медицина», однако вопросы кровотечения и гемостаза с самого начала ее развития являлись одними из ключевых, так как были направлены на спасение жизни. Однако лишь в 1905 году миру была представлена классическая модель гемостаза (по Моравицу), были описаны фазы активации, коагуляции и ретракции.
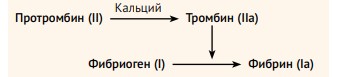
Учитывая, что данная теория не могла объяснить множество факторов, связанных с гемостазом, в течение следующих 50 лет была разработана более совершенная, каскадная модель гемостаза (1964 год). Она включает в себя внутренний путь, активируемый компонентами, которые можно обнаружить во внутрисосудистом пространстве и внешний, который запускается элементами, которые в норме отсутствуют в внутрисосудистом русле (находятся в субэндотелиальном слое).
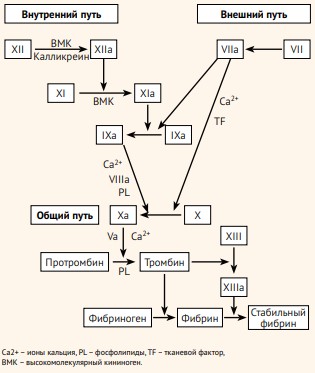
В настоящее время такого описания системы гемостаза уже недостаточно для полноценного понимания всех процессов, в том числе для работы в клинической практике. Изолированная каскадная модель гемостаза, прекрасно объясняя процессы in vitro, не может объяснить многие механизмы коагуляции при патологии in vivo, а именно – связь между собой внутреннего и внешнего путей коагуляционного гемостаза, тромбоцитарного пути гемостаза, а также влияние системы противосвертывания/фибринолиза. Она описана как каскад с «законченным» действием. Что не совсем корректно, так как все процессы гемостаза имеют место быть циклично, по спирали, усиливая или ослабляя следующий виток, в зависимости от «клинической ситуации», потребностей и резервов организма. Например:
- дефицит фактора XII удлиняет АЧТВ (показатель внутреннего пути), однако кровотечения при дефиците XII у пациентов не возникают (приобретенный дефицит этого фактора можно наблюдать при тромбофилии на фоне васкулитов или ДВС-синдроме);
- низкое количество высокомолекулярных кининогенов/прекалликреина подразумевает спонтанные кровотечения, что не происходит в реальной практике;
- с другой стороны, при гемофилии А внешний путь коагуляции не способен компенсировать низкое количество VIII фактора, а при гемофилии В (дефицит IX) внешний путь свертывания не затронут, но наблюдаются множественные кровотечения, в то же время, при гемофилии С (дефицит XI) кровотечения носят не выраженный характер;
- как оказалось, отсутствие сбоя в работе внутреннего каскада не способно компенсировать дефицит факторов внешнего пути, дефицит VII вызывает кровотечение даже при функционировании внутреннего пути.
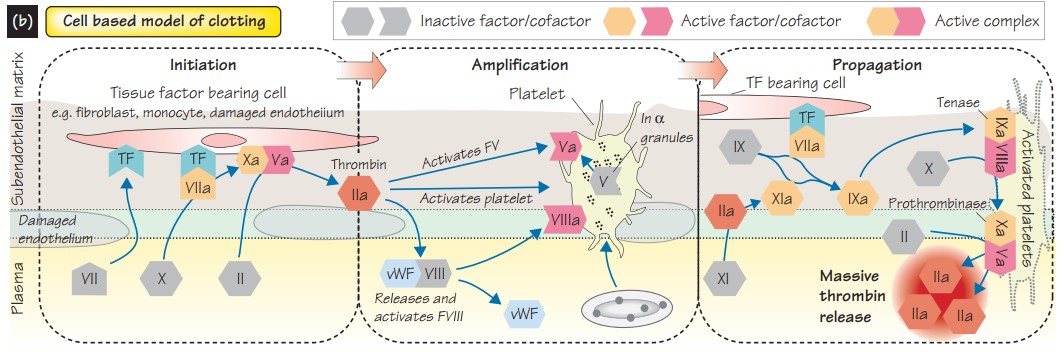
Стоит упомянуть, что в начале 2000х, как дополнение к существующим была предложена клеточная теория гемостаза. Она более детально описывает тромбоцитарый механизм гемостаза(инициация, амплификация, пропагация, терминация), а также связь с коагуляционным механизмом.
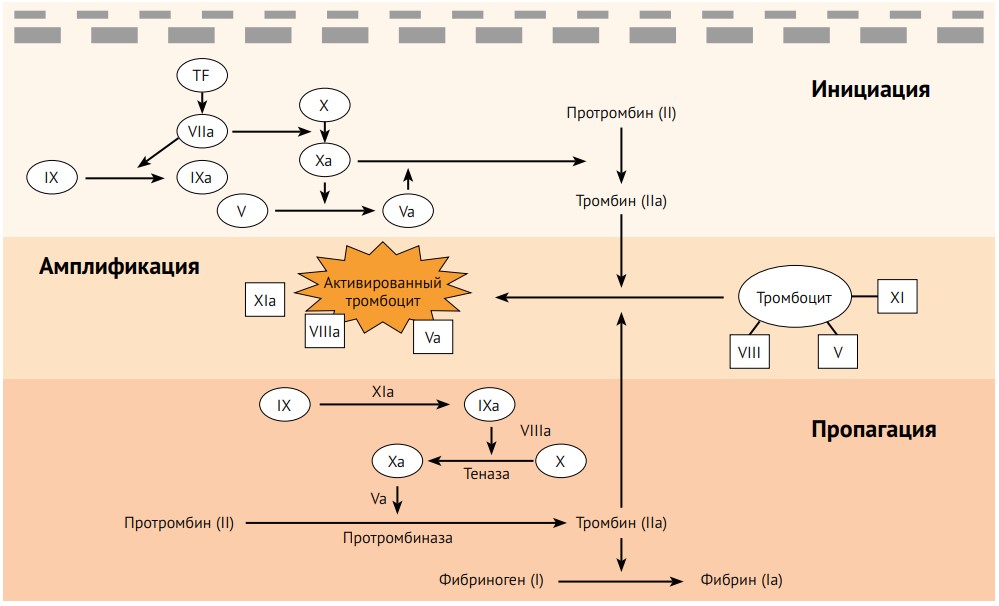
Как уже упоминалось выше, весь сложный процесс коагуляционного гемостаза направлен на массивный выброс тромбина (IIa фактор). Согласно клеточной теории гемостаза, многие процессы происходят именно на поверхности клеток, а не только в плазме крови.
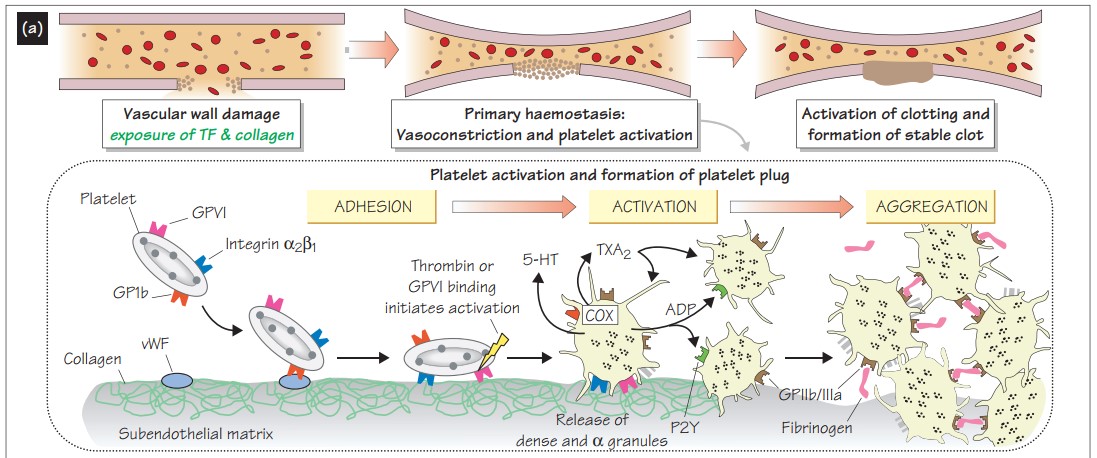
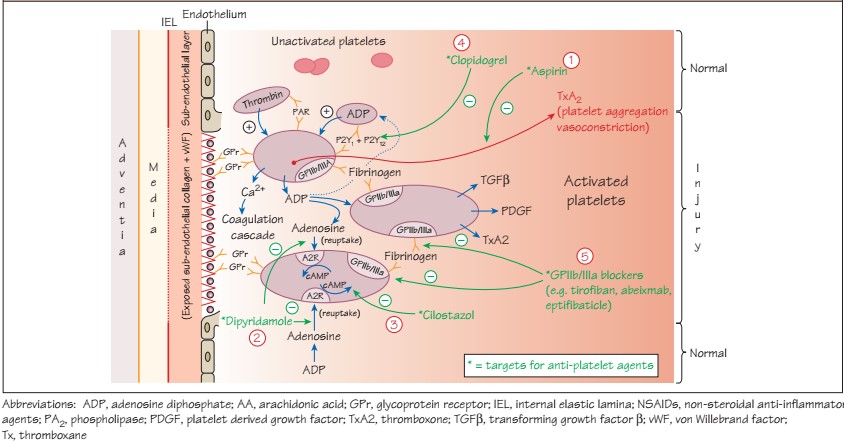
Как первичный ответ на травму сосуда возникает вазоконстрикция, которая снижает поток крови. Те клетки, которые находятся в субэндотелиальном слое – фибробласты, моноциты, а также микрочастицы разрушенного эндотелия (содержат тромбопластин – тканевой фактор (TF), который активирует VII фактор) запускают «внешний путь». В этот же момент коллаген субэндотелиального матрикса связывается с фактором von Willebrand (vWF), который в свою очередь связывается с гликопротеиновым рецептором на тромбоците, что приводит к адгезии, а также к высвобождению Ca2+. Затем происходят дополнительные связи с тромбоцитарным интегрином и другими рецепторами – активация. Тромбоциты меняют свою форму, выпускают псевдоподии, воспроизводят тромбоксан A2 (TXA2)через циклооксигеназный путь (COX), а также тканевой фактор роста-бета (TGF- β). TXA2 способствует высвобождению ряда медиаторов (серотонин, АДФ, фактор V), которые в свою очередь также усиливают вазоконстрикцию. АДФ стимулирует другие тромбоциты через P2Y12 рецепторы, вызывает на тромбоците активацию наиболее многочисленных агрегационных рецепторов фибриногена (GPIIb/IIIa). Фибриноген плазмы связывается с GPIIb/IIIa тромбоцитов, что приводит к агрегации и образованию тромба, затем происходит стабилизация тромба фибрином.
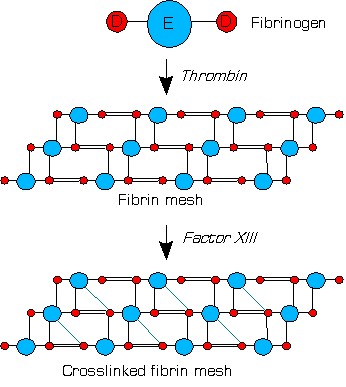
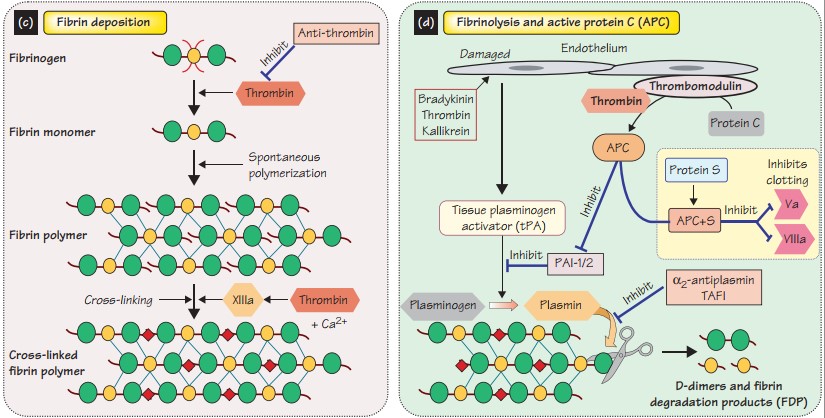
После цикличных каскадов с образованием тромбина, активации XIII (фибринстабилизирующего фактора) под воздействием тромбина и Ca2+, который повышает устойчивость фибринового сгустка к лизису и формирует стабильный тромб, с целью предотвращения коагуляции в зоне здоровых тканей действуют элементы противосвертывающей системы, а именно: антитромбин III, TFPI, протеин С и его кофактор, протеин S. Данные факторы позволяют ограничить коагуляцию и, соответственно, являются естественными антикоагулянтами.
Как-то однажды меня спросили на экзамене за Д-димеры. Я нарисовал схему стабилизации тромба и его распада под действием агентов фибринолиза. Вопросов у экзаменатора больше не было.
Антитромбин III ингибирует фактор Xa и IXa-tenase, тромбин; его действие значительно усиливается вместе с кофактором – полисахаридом гепарина II. Похожее действие у гепаранов.
Тромбомодулин на эндотелии связывает тромбин и предотвращает изменение фибриногена (в фибрин), вместо этого, тромбомодулин активирует протеины C и S.
Протеины C и S ингибируют факторы Va и VIIIa, следовательно ограничивают активирование протромбина и X фактора.
TFPI (ингибитор пути тканевого фактора) связывает и ингибирует Xa фактор и комплекс VIIa-тканевой фактор.
Тканевой активатор плазминогена высвобождается клетками эндотелия, связывается непосредственного с фибрином и конвертирует плазминоген в плазмин, тем самым переводит фибрин в растворимую форму. Это создает продукты деградации фибрина, включая малые Д-димеры.
Простациклин (PGI2) и оксид азота высвобождаются неповрежденным эндотелием, – снижают адгезию и активацию тромбоцитов.
Основные шаги коагуляции – повреждение сосудистой стенки, высвобождение тканевого фактора, агрегация тромбоцитов и коагуляционный каскад (внешний, наиболее важный in vivo, и внутренний пути) связаны между собой.
В моем понимании, максимально понятно систему гемостаза описывает “симбиоз” каскадной и клеточной теорий – я ее называю «спиральная теория». Она действует по принципу автоволны, как пример – костяшки домино. Эта теория описывает спираль, которая продолжается из цикла в цикл, влияя на каждый следующий, теория позволяет объединить между собой все звенья гемостаза в единый путь. Становится логичным и понятным, что два пути гемостаза неразрывно связаны между собой, а также присутствуют элементы обратной связи, в т.ч. с системой фибринолиза.
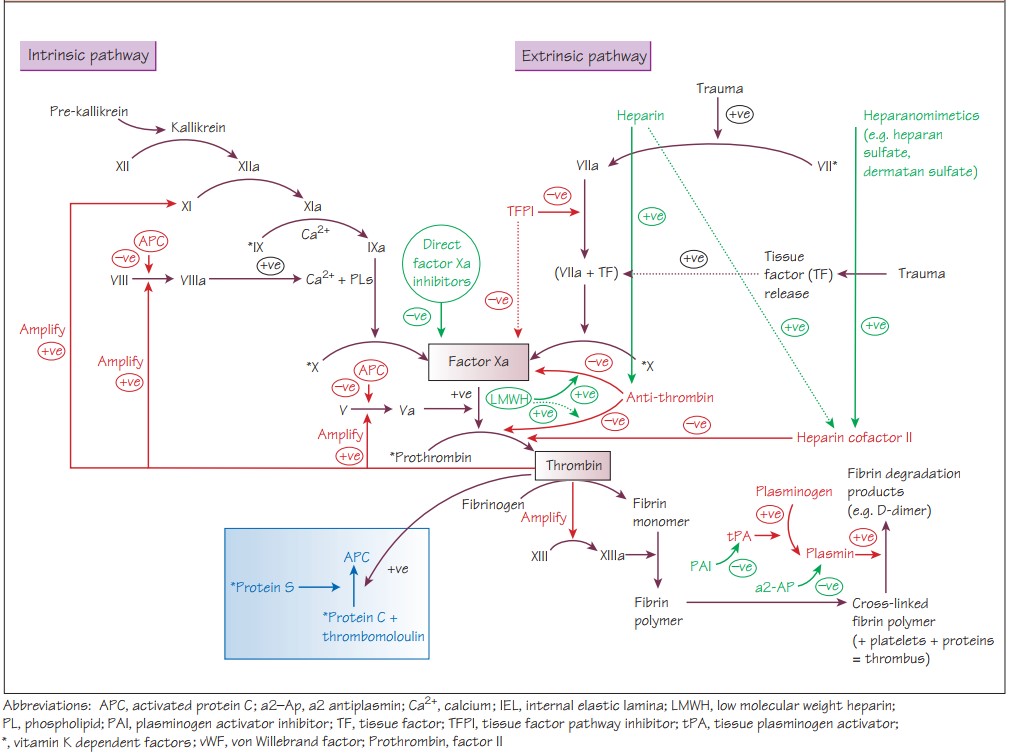
Как и все в природе, система гемостаза должна находится в равновесии. При смещении равновесия в сторону гиперкоагуляции (триада Вирхова), возникает тромбоз, в сторону гипокоагуляции - кровотечение.

Общие факторы: возраст, ожирение, курение/злоупотребление алкоголем, обезвоживание, тяжелые инфекции и хроническое воспаление.
Артериальный тромбоз/тромбоэмболия (чаще из-за повреждения эндотелия): прямая травма сосуда, атеросклероз и разрыв атероматозной бляшки, аритмии.
ВТЭО – ТПВ, ТГВ, ТЭО + ТЭЛА (чаще из-за нарушения локальной гемодинамики и изменения вязкости крови): иммобилизация, ОСН/ХСН, операционная травма; заболевания крови, прием КОК, генетические нарушения факторов системы фибринолиза; травмы сосуда (катетер, гнойный процесс, прямая травма), острые инфекционные состояния (в т.ч. вирусные). Если кому интересно – изменения в системе гемостаза при COVID-19.
Обязательно необходимо разделять артериальный тромбоз/тромбоэмболию и венозный тромбоз/тромбоэмболию. Стоит помнить, что артериальные тромбы (белые) состоят преимущественно из тромбоцитов (более 50%) – в связи с этим, наиболее «таргетный» путь профилактики – воздействие на сосудисто-тромбоцитарный путь. Венозные тромбы (красные) более чем на 50% состоят из лейкоцитов и других ядросодержащих клеток крови (воспаление – как основной триггер) – поэтому здесь лечение зиждется на антикоагулянтах – воздействие на коагуляционный путь гемостаза.
Основные противопоказания – это кровотечение, аллергия. Все остальные ситуации – относительны и требуют индивидуального мультимодального подхода.
Я не буду рассматривать лекарства для усиления или стимуляции фибринолиза. Коснемся лишь основных моментов касательно антикоагулянтов и антитромбоцитарных лекарственных средств.
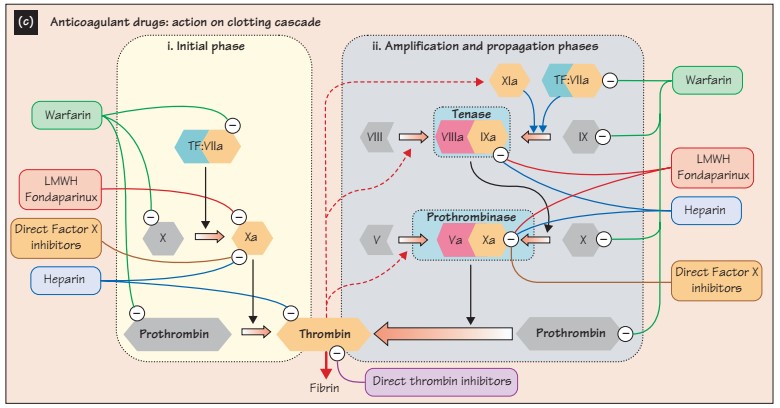
Начнем с антикоагулянтов.
Фактор X и протромбин-тромбиновый комплекс составляют финальный общий путь коагуляционного каскада, соответственно, являются основной целью для ингибирования.
Ингибиторы тромбина:
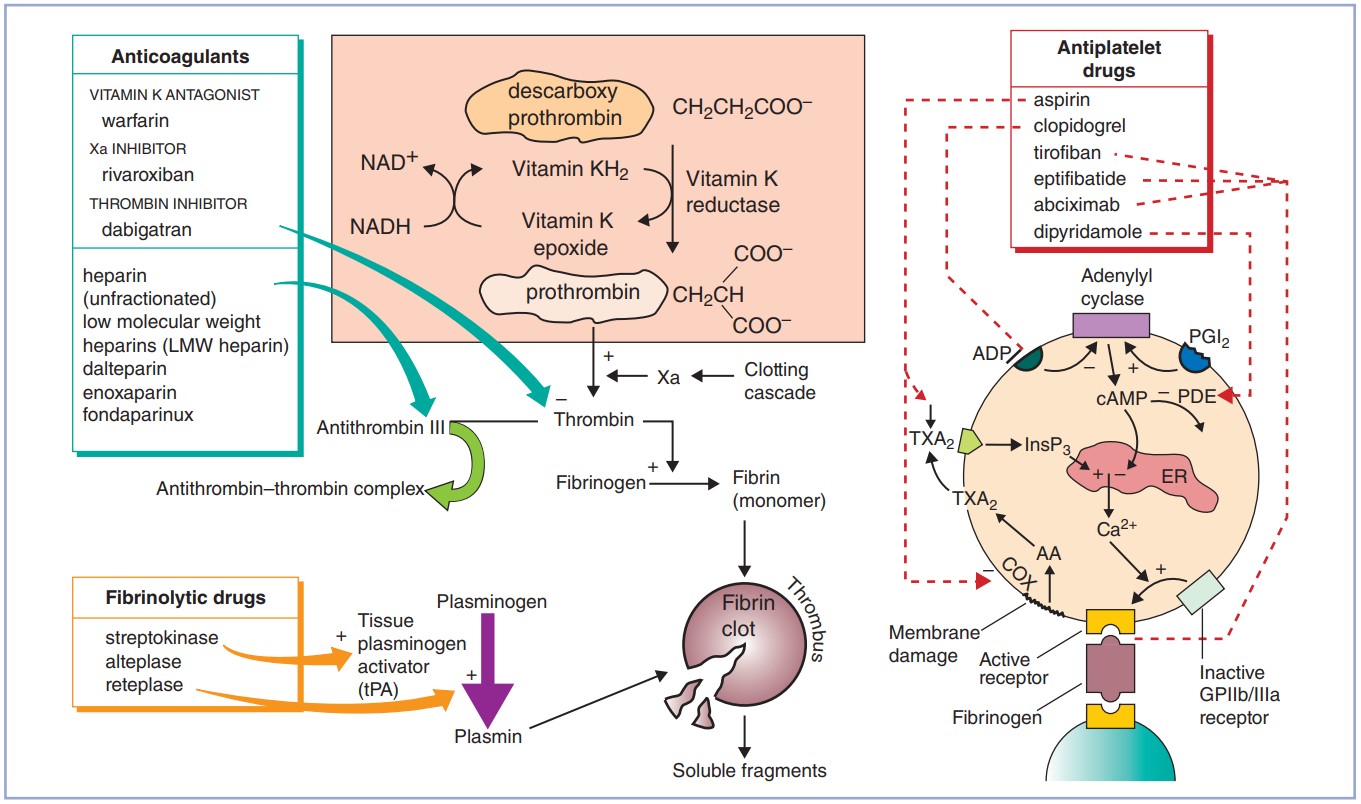
Прямые: Дабигатрана этексилат обратимо связывается с тромбином, предотвращает тромбин-медиаторную активацию других коагуляционных фактор (нарушается цикл/спираль). Более того, дабигатран может инактивировать тромбин даже при связи последнего с фибрином, это ингибирует тромбиновую ингибицию фибринолиза (опосредованно стимулирует фибринолиз). Антидот – Idarucizumab; можно использовать протромбиновый комплекс, офф-лэйбл человеческий рекомбинатный фактор VIIа, гемодиализ.
Непрямые: Гепариноиды – полисахариды различных размеров, потенциальные ингибиторы тромбина через связывание и изменение активности AT III. Нефракционированный гепарин (НФГ) – гетерогенная смесь олигосахаридов разного размера (соответственно, биологическая активность – 20-30%). Фракционированные гепарины (низкомолекулярные, НМГ) – очищенное объединение химически отобранных легких цепей олигосахаридов. Следовательно, НМГ – более активная смесь с более предсказуемыми фармакодинамикой и фармакокинетикой (по сравнению с НФГ). Для ингибирования тромбина, гепариноид должен связаться с тромбином и АТ III. Иначе, при связи только с АТ III (возможно лишь для НМГ) в меньшей степени ингибируют только Xa фактор (anti-Xa эффект), и в значительно меньшей степени IX и XI. Антидот гепариноидов – протамина сульфат; исходя из вышеописанного, он действует на НФГ и НМГ, однако, он менее эффективен в отношении НМГ и требует коррекцию дозировки при нарушении почечной функции.
Ингибиторы Xa фактора – это пентасахариды, связывающие непосредственно Xa фактор.
Ривароксабан. Всем известен, в настоящий момент применяется как при лечении ВТЭО, так и для профилактики ССС при аритмиях и мультифокальном атеросклерозе. Антидот – Andexanet alfa.
Рекомбинантные гирудины (лепирудин, десирудин и синтетические аналоги гирудина (бивалирудин, аргатробан). Некоторые авторы описывают влияние их и непосредственно на тромбин. Могут применяться при ГИТ (гепарин-индуцированной тромбоцитопении). Вводятся внутривенно.
Фондапаринукс – синтетический пентасахарид, который связывает АТ III, селективно ингибирует Xa фактор, и косвенным образом блокирует воспроизводство тромбина (стимулирует антитромбин-зависимые ингибирующие факторы). Имеет практически 100% биодоступность при подкожном введении, выводится только почками. Не влияет на связанный тромбин и на тромбоциты. Применяется при ГИТ. Из интересного, существует гиперметилированный дериват фондапаринукса – Идрапаринукс – имеет T1/2 около 80 часов, может вводится 1 раза в неделю.
Другие антикоагулянты.
АВК (варфарин, аценокумарол, фениндион) – антагонист витамина К, следовательно ингибирует воспроизведение II, VII, IX и X (витамин-К зависимых факторов) в печени.
Nota Bene! Варфарин также тормозит по такому же пути антикоагулянтные протеины C и S (помнить при назначении АВК, только после 3-5 дневной под контролем АЧТВ нагрузке НФГ, например), что может привести к варфарин-инфуцированному некрозу кожи и т.д.
Декстраны – полимеры различной массы (декстран-70 и декстра-40) обладают дозо-зависимым ингибирующим эффектом на агрегацию тромбоцитов, VIII фактор, vWF, а также стимулируют фибринолиз. Применяется при различных острых состояниях, но и имеет множество побочным эффектов (кровотечение, аллергия, нефротоксичность, анафилактоидные реации гемотрансфузии).
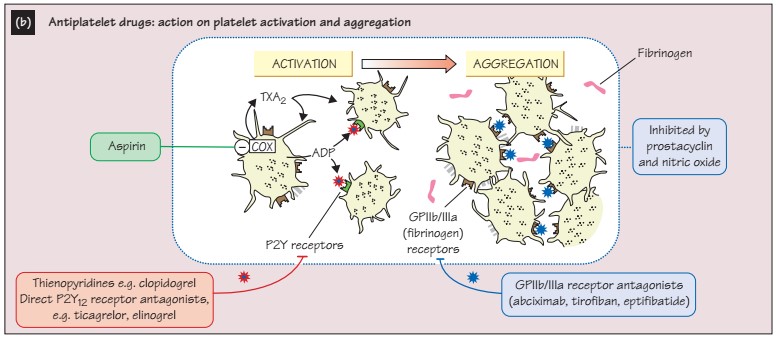
Немного про точки приложения антитромбоцитарных лекарств.
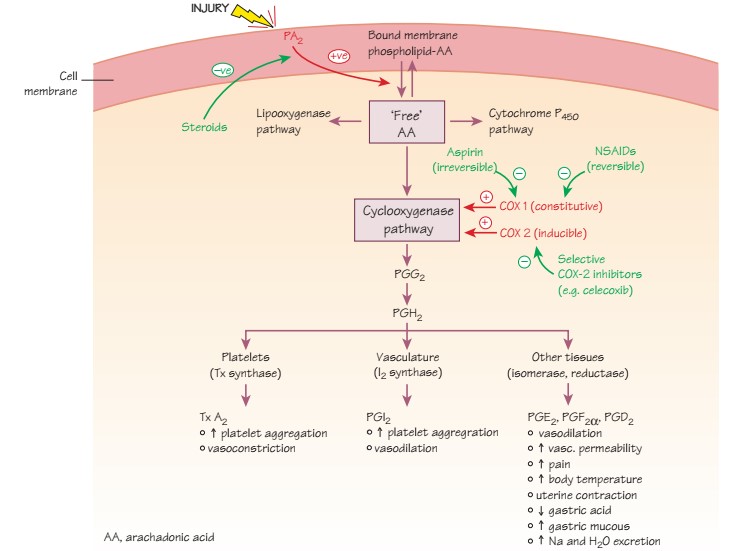
Арахидоновая кислота (AA) в норме находится в фосфолипидах клеточной мембраны, после повреждения клетки свободная АА может вступать в циклооксигеназный путь, где под воздействием циклооксигеназы (COX) превращается в простагландины (PG). Существует два вида COX. COX-1 экспрессируется в норме постоянно в большинстве тканей, включая ЖКТ, тромбоциты и почечную ткань. COX-2, как правило, индуцируется в ответ на повреждение (включая повреждение эндотелия) и как воспалительный ответ (является источником синтеза PG). Среди множества эффектов PG, присутствуют эффекты на сосудистую систему: вазодилятация (PGI2, PGE2), ингибирование тромбоцитов (PGI2, PGF2alfa), агрегация тромбоцитов и вазоконстрикция (тромбоксан А2).
Как уже упоминалось ранее, тромбоциты активируются высвобожденным субэндотелиальным коллагеном, тромбином и АДФ через P2Y12 рецепторы на поверхности тромбоцитов.
Активированные тромбоциты связывают коллаген, vWF через GPIIb/IIIa рецепторы, затем происходит дополнительное высвобождение АДФ и Ca2+. Через множество GPIIb/IIIa рецепторов и активные псевдоподии тромбоциты образуют тромб.
Через тромбоксан А2 (TxA2), факторы роста тромбоцитов происходит усиление каскада активации и агрегации тромбоцитов, стимуляция гладкомышечных клеток сосудистой стенки с вазоспазмом.
Препараты направленные на снижение агрегации тромбоцитов.
Воздействие на путь арахидоновой кислоты.
Кортикостероиды – ингибируют фосфолипаза-А2-путь высвобождения АА из клеточных мембран и снижают индукцию COX-2 в ответ на травму. Однако, стероиды не влияют на изменение степени рестеноза при лечении стенозирующе-окклюзионных поражений артерий и обладают значительным рядом побочных эффектов.
НПВС – ингибиторы COX-1 и COX-2, следовательно и синтез PG. Так как COX-2-опосредованные механизмы ответственны за рестеноз, агрегацию тромбоцитов, то изолированный блок циклооксигеназы-2 может ингибировать эти процессы. Однако, в это же время, препараты селективные ингибиторы COX-2 ассоциированы с увеличением риска коронарного тромбоза и их применение рассматривается как крайний вариант у пациентов с высоким риском или после ССС.
Самый «популярный» НПВС – Аспирин – acidum acetylsalicylicum – необратимый ингибитор COX-1-зависимого пути синтеза TxA2 (участвует в вазоконстрикции и агрегации тромбоцитов). Кроме того, высокие дозы аспирина, также ингибируют эндотелиальный PGI2, который отвечает за обратные эффекты. Неповрежденные клетки эндотелия способны вновь восстановить эндотелиальный PGI2, а тромбоциты, которые не имеют ядра, не способны к новой продукции TxA2, эти приводит к значительному увеличению соотношения PGI2/ TxA2 (преобладает эффект вазодилятации и ингибирования агрегации тромбоцитов), такой эффект длится 7-10 дней (время восстановления нового пула тромбоцитов).
Воздействие на обмен АДФ.
Дипиридамол (ингибитор ФДЭ-5) ингибирует захват аденозина через аденозиновые A2 рецепторы, что приводит к внутриклеточному увеличению цАМФ (является эндогенным слабым вазодилятатором и ангиагрегантом).
Цилостазол (ингибитор ФДЭ-3), через увеличение цАМФ и накопление его активирует протеин-киназу-А (PKA), которая непосредственно участвует в ингибировании агрегации тромбоцитов. Кроме того, PKA также предотвращает активацию белка (киназу легких цепей миозина), который играет роль в сокращении гладкомышечных клеток, что приводит к вазодилятации.
Селективное ингибирование рецепторов АДФ приводит к нарушению агрегации тромбоцитов.
Клопидогрел и новые тиенопиридины (тиклопидин, прасугрел) обладают антитромбоцитарным и противовоспалительным (по некоторым данным) эффектами. Они селективно (в случае клопидогрела – его метаболит – в течение 24 часов в печени) и необратимо блокируют P2Y12 рецепторы, которые нарушают присоединение АДФ, что приводит к сниженной активации GPIIb/IIIa рецепторов, также нарушается АДФ-зависимый путь связывания с фибриногеном, что приводит к нарушению агрегации.
Конечный этап общего пути агрегации тромбоцитов включает в себя перекрестное взаимодействие активированных тромбоцитов с белками плазмы (фибриноген) через GPIIb/IIIa рецепторы.
Селективные ингибиторы GPIIb/IIIa рецепторов (тирофибан, абциксимаб, эптифибатид) являются мощными антитромбоцитарными веществами, в настоящий момент используются преимущественно при ЧКВ (как профилактика феномена no-reflow).
В контексте данной статьи, думаю, можно упомянуть еще несколько ЛС.
Статины (ингибиторы ГМК-КоА редуктазы) – ингибируют превращение ГМК-КоА в мевалоновую кислоту, тем самым снижают синтез холестерола и усиливают клиренс ЛПНП, как следствие регулируется соотношение ЛПНП и ЛПВП в сторону увеличение последних. Статины также имеют дополнительный плеотропный эффект (из-за уменьшения количества мевалоновой кислоты): стабилизация эндотелия и атеросклеротической бляшки, противовоспалительный, снижение тромбоцитарной агрегации и антитромботический эффект, ингибирование клеточной пролифирации.
Блокаторы Ca2+ каналов. Ионы кальция (Ca2+) имеют многофакторную роль в сосудистой физиологии, а именно: агрегация тромбоцитов, коагуляционный гемостаз, пролиферация и активация различных рецепторов, стимуляция гладкой мускулатуры. Например, блок потенциал-зависимых кальциевых каналов на рецепторах ангиотензина блокирует атеросклероз в эксперименте. К сожалению, пока мало данных о профилактике или лечении тромботических состояний.
Оксид азота (NO) (нитраты как ЛС) вырабатывается неповрежденным эндотелием, и отвечает за вазодилятацию (при воздействии стрессового агента на сосудистую стенку), а также за тонус сосуда в покое через эффект на рецепторы АТ1. Влияя на рецепторы АТ1 (увеличивает циклический гуанозин монофосфат) снижает агрегацию тромбоцитов, адгезию лейкоцитов. Нарушение продукции оксида азота сопровождается гипертензией, ишемией-реперфузией, атеросклерозом и неоинтимальной гиперплазией.
Напоследок, пару моментов из базовой лабораторной диагностики системы гемостаза, которая должна быть в каждом стационаре/поликлинике/амбулатории (не берем сюда системы агрегатометрии, тромбоэластографы и т.д.)
Протромбиновое время (PT) – время формирования сгустка при добавлении тромбопластина (TF). Важно для оценки витамин-К-зависимых факторов. Соотношение PT пациента к стандарту = INR (МНО).
АЧТВ (aPTT) – время формирования сгустка при добавлении поверхностного активатора (каолина) XII фактора, фосфолипидов и Ca2+ к плазме. Контроль внутреннего пути коагуляционного каскада.
Д-димер (продукт деградации фибрина) – показатель фибринолиза, неспецефичен, высокочувствителен. Увеличивается при гиперкоагуляции (тромбозы) и еще с десяток других состояний (травма, инфекции, системные заболевания, беременность, COVID-19 и т.д.).
И да, загляните сюда:
- Aaronson PI, Connelly MJ, Ward JPT. The Cardiovascular System at a Glance.
- Neal MJ. Medical Pharmacology at a Glance.
- Stephenson M, McMonagle M. Vascular and Endovascular Surgery at a Glance.
- Schastlivtsev I.V., Lobastov K.V., TSaplin S.N., Mkrtychev D.S. Modern view on hemostasis system: cell theory. (in rus.)
Надеюсь, что после прочтения обзора, в какой-то мере знания о системе гемостаза слегка утрамбовались в чертогах разума и глубинах памяти. Если кто-то нашел ошибку – всегда рад дискуссии. И смогу признать свои ошибки.
Хорошего дня, берегите себя и любите близких!